Mẹo Hướng dẫn Clo hóa là gì Chi Tiết
Bann đang tìm kiếm từ khóa Clo hóa là gì 2022-03-21 14:14:06 san sẻ Mẹo về trong nội dung bài viết một cách 2022.
I. TÍNH CHẤT VẬT LÍ – Clo là chất khí, màu vàng lục, mùi hắc. – d(Cl2 /kk)= 2,5 và tan được trong nước. – Tác dụng sinh lí: Clo là một khí độc. II. TÍNH CHẤT HÓA HỌC 1. Clo có những tính chất hóa học của phi kim a) Tác dụng với hầu hết sắt kẽm kim loại → muối clorua Phương trình hóa học: 2Fe + 3Cl2 ( xrightarrow[]t^0) 2FeCl3 b) Tác dụng thuận tiện và đơn thuần và giản dị với hiđro → khí hiđro clorua Phương trình hóa học: H2 + Cl2 ( xrightarrow[]t^0) 2HCl (khí hiđro clorua) Kết luận: Clo có những tính chất hóa học của phi kim. Clo là một phi kim hoạt động giải trí và sinh hoạt hóa học mạnh, clo không trực tiếp phản ứng với oxi. 2. Tính chất hóa học khác của clo a) Tác dụng với nước Phương trình hóa học: Cl2 (k) + H2O ( rightleftharpoons) HCl (dd) + HClO (dd) Nước clo là dung dịch hỗn hợp những chất HCl, HClO và Cl2 nên có màu vàng lục, mùi hắc của khí clo. Nếu cho quì tím vào dd đó, lúc đầu quì tím hóa đỏ, tiếp sau đó nhanh gọn bị mất màu là vì tác dụng oxi hóa mạnh của axit hipoclorơ HClO. Hình 1: Minh họa cho quỳ tím vào nước clo – Nước clo có tính tẩy màu, sát trùng. b) Tác dụng với dung dịch kiềm (NaOH, KOH, …) Phương trình hóa học: Cl2 + 2NaOH -> NaCl + NaClO + H20 Dung dịch hỗn hợp gồm NaCl (natri clorua) và NaClO (natri hipoclorit) được gọi là nước Gia-ven. Dung dịch này còn có tính tẩy màu vì tương tự như HClO, NaClO có tính oxi hóa mạnh. III. ỨNG DỤNG CỦA CLO – Nước clo dùng khử trùng nước sinh hoạt trong nhà máy sản xuất nước. – Tẩy trắng vải sợi, bột giấy…. – Điều chế nước Gia – ven, clorua vôi… – Điều chế nhựa PVC, chất dẻo, chất màu… IV. ĐIỀU CHẾ KHÍ CLO 1. Trong phòng thí nghiệm Phương pháp: Đun nóng nhẹ dung dịch HCl đậm đặc với những chất oxi hóa mạnh như MnO2, KMnO4,… Phương trình hóa học: Mn02 + 4HCl ( xrightarrow[]t^0) MnCl2 + Cl2 + 2H2O Thu khí clo bằng phương pháp đẩy không khí 2. Trong công nghiệp Phương pháp: Điện phân dd NaCl bão hòa (có màng ngăn không cho khí Cl2 thoát ra tác dụng với NaOH tạo thành nước Gia-ven) Phương trình hóa học: 2NaCl + 2H2O ( xrightarrow[m.n]dpdd) 2NaOH + Cl2 + Н2 Sơ đồ tư duy: Clo 18:39:5623/01/2019 Clo (Cl) là chất khí có màu vàng lục mùi xốc, rất độc. Clo là nguyên tố halogen tiêu biểu vượt trội và quan trọng nhất. Vậy Clo (cl) có tính chất hóa học và tính chất vật lý ra làm thế nào? Điều chế Clo bằng phương pháp nào và Clo có những ứng dụng gì trong thực tiễn, toàn bộ chúng ta cùng tìm hiểu qua nội dung bài viết tại đây. * tin tức tóm tắt về Clo (Cl):
I. Tính chất vật lý của Clo (Cl) – Clo là chất khí độc, màu vàng lục, mùi xốc, nặng hơn không khí. – Khí clo tan vừa phải trong nước tạo thành nước clo có màu vàng nhạt. Clo tan nhiều trong những dung môi hữu cơ. – Trong tự nhiên clo có 2 đồng vị bền là 35Cl và 37Cl
– Do lớp e ngoài cùng đã có 7e nên clo là phi kim nổi bật nổi bật, dễ nhận thêm 1e (thành Cl-) thể hiện tính oxi hóa mạnh (chỉ kém F và O). – Trong những hợp chất, clo thường có mức oxi hóa -1; trong hợp chất với F hoặc O, clo còn tồn tại mức oxi hóa +1; +3; +5; +7. Vì vậy trong một số trong những phản ứng, clo còn tồn tại tính khử. 1. Clo tác dụng với sắt kẽm kim loại – Clo (Cl) phản ứng với hầu hết những sắt kẽm kim loại trừ Au và Pt → muối halogenua. Muối thu được thường ứng với mức hóa trị cao của sắt kẽm kim loại. – PTPƯ tổng quát: 2M + nCl2 → 2MCln * Ví dụ:
2. Clo phản ứng với hiđro tạo thành hiđro clorua Cl2 + H2 – Khí hiđro clorua HCl không màu và dễ tan trong nước. – Trong phản ứng với sắt kẽm kim loại và hiđro Clo đóng vai trò chất oxi hóa. 3. Clo tác dụng với nước – Khi tan trong nước một phần clo phản ứng với nước tạo thành hỗn hợp 2 axit clohiđric và axit hypoclorơ. Cl2 + H2O HCl + HClO – Trong phản ứng với H2O Clo vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa. 4. Clo tác dụng với dung dịch kiềm – Nếu dung dịch kiềm loãng ngoại Cl2 + NaOH loãng, nguội → NaCl + NaClO + H2O (nước javen) Cl2 + Ca(OH)2 → CaOCl2 + H2O – Nếu dung dịch kiềm đặc nóng 3Cl2 + 6KOH 5. Clo đẩy Brom và iot khỏi muối bromua và iotua (không đẩy được Florua) Cl2 + 2NaBr → 2NaCl + Br2 Cl2 + 2KI → 2KCl + I2 6. Clo tác dụng với những hợp chất có tính khử Cl2 + NH3 → N2 + 6HCl (phản ứng được vốn để làm khử độc clo trong phòng thí nghiệm) 4Cl2 + H2S + 4H2O → 8HCl + H2SO4 III. Điều chế Clo 1. Điều chế Clo trong phòng thí nghiệm – Dùng chất oxihóa mạnh như MnO2, KMnO4, KClO3 ,… tác dụng dung dịch HCl đặc hoặc muối Clorua MnO2 + 4HCl → MnCl2 + Cl2 + H2O 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O 2. Điều chế Clo trong công nghiệp – Điện phân dung dịch NaCl có màng ngăn bằng xốp với điện cực dương bằng than chì và điện cực âm làm bằng sắt. 2NaCl + 2H2O IV. Bài tập về Clo (Cl) Bài 5 trang 101 sgk hóa 10: Cân bằng những phương trình phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron: a) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O. b) HNO3 + HCl → NO + Cl2 + H2O. c) HClO3 + HCl → Cl2 + H2O. d) PbO2 + HCl → PbCl2 + Cl2 + H2O. Lời giải bài 5 trang 101 sgk hoá 10: a) b) c) d) Bài 7 trang 101 sgk hóa 10: Cần bao nhiêu gam KMnO4 và bao nhiêu ml dung dịch axit clohiđric 1M để điều chế khí clo tác dụng với sắt, tạo ra 16,25g FeCl3? Lời giải bài 7 trang 101 sgk hóa 10: – Theo bài ra, ta có: nFeCl3 = m/M = 16,25/162,5 = 0,1 (mol) – Phương trình hóa học của phản ứng: 3Cl2 + 2Fe → 2FeCl3 Theo PTPƯ: nCl2 = (3/2).nFe = (3/2).0,1 = 0,15 (mol) 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O Theo PTPƯ: nKMnO4 = (2/5).nCl2 = (2/5).0,15 = 0,06 (mol) nHCl = (16/5).nCl2 = (16/5).0,15 = 0,48 (mol). mKMnO4 cần = 0,06. 158 = 9,48 (g). ⇒ Vdd HCl = n.CM = 0,48.1 = 0,48 (lít). Hy vọng với phần khối mạng lưới hệ thống lại tính chất hóa học của Clo và bài tập ứng dụng ở trên hữu ích với những em. Mọi vướng mắc những em hãy để lại phản hồi dưới nội dung bài viết để được tương hỗ, nếu thấy nội dung bài viết hay những em hãy san sẻ, chúc những em học tập tốt. ¤ Xem thêm những nội dung bài viết khác tại: » Mục lục nội dung bài viết SGK Hóa 10 Lý thuyết và Bài tập » Mục lục nội dung bài viết SGK Vật lý 10 Lý thuyết và Bài tập Video tương quan |
Chia sẻ
đoạn Clip Clo hóa là gì ?
Một số hướng dẫn một cách rõ ràng hơn về Video Clo hóa là gì tiên tiến và phát triển nhất .
Chia Sẻ Link Down Clo hóa là gì miễn phí
Quý quý khách đang tìm một số trong những Chia Sẻ Link Cập nhật Clo hóa là gì miễn phí.
#Clo #hóa #là #gì




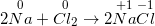
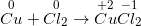
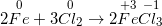
 2HCl
2HCl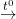 5KCl + KClO3 + 3H2O
5KCl + KClO3 + 3H2O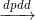 2NaOH + H2 + Cl2
2NaOH + H2 + Cl2






